Boa tarde 16:09 04.07 hoje começaremos a falar sobre elementos químicos, símbolos, dentre outros que na realidade é a base de toda nossa questão química, lhes apresento abaixo, informalmente por enquanto a nossa tabela periódica, a qual mesmo que para alguns inicialmente possa parecer tão assustadora e incompreendida é muito fácil e prática de compreender,

Bem acredito que uma das primeiras coisas que devemos saber quando pensamos no conteúdo de hoje é sobre os elementos químicos, que pra mim funcionam mais ou menos como o alfabeto funciona com as palavras, pra formas as palavras você precisa deles, pra formar as fórmulas, pra compreender como as coisas são formadas você precisa dele e como química, você REALMENTE precisa saber deles, então fiquei pensando.. como vou colocar eles pra que vocês conheçam e encontrei esse site abaixo que tem sobre cada um, caso tenham interesse entrem nele e deem uma olhada, no mais com o decorrer do tempo você acaba conhecendo um pouco de qualquer forma
Sobre cada um deles aqui: AQUI
Bem, traduzindo isso, é assim: Cada elemento que estão representados nos quadradinhos da tabela ali em cima.. é formado por átomos que possuem uma numeração chamada de número atômico. é o número atômico é o número de prótons do átomo. A tabela periódica trás inúmeros elementos químicos que são representadas pelas letras, exemplo o H é o Hidrogênio, o N é o nitrogênio.. e assim vai, No total de 118 elementos, mais de 80 deles são elementos naturais e o restante são produzidos de forma artificialDEFINIÇÃO: Elemento químico é um conjunto formado de átomos que possuem o mesmo número de prótons em seu núcleo, isto é, o mesmo número atômico (Z). Cada elemento é reconhecido por um símbolo.
Abaixo está exemplificado o que significa cada uma das informações referentes a um elemento químico, no caso descrito é o Ferro nossa vitima.
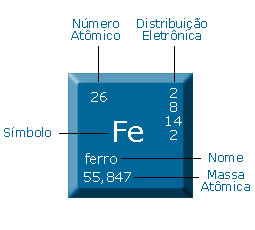
todos os elementos possuem número atômico, massa, nome, símbolo .. PF (ponto de fusão) PE (ponto de ebulição) dentre tantas outras informações. É a partir daí que nossas HABILIDADES ESPECIAIS aparecem, pois é com a tabela periódica que começamos a entender como eles são e vamos observar como eles são organizados e como isso influencia nas suas características.
Os Símbolos dos elementos são constituídos pela inicial maiúscula dos seus nomes latinos ou gregos, eventualmente, seguida ou não da segunda letra minuscula de seu próprio nome. Os símbolos usados atualmente foram introduzidos na química em 1811, pelo químico sueco John Jacob Berzelius
Abaixo tem o exemplo de alguns elementos, com seu nome em latim e seu respectivo Símbolo.

AGORA CAPTEM : coloquei novamente a tabela periódica e fiz um tracejadinho tosco que é para vocês compreenderem onde eu estou querendo chegar, a parte das fileiras HORIZONTAIS indicadas com o tracejado AZUL, são chamados PERÍODOS ou COLUNAS. e os VERTICAIS indicadas com o tracejado VERMELHO são os GRUPOS.
Obs.: não estou me referindo somente a fileira ou grupo que tracejei, isso foi somente para exemplificar a direção em que estamos observando. (:
As famílias, são distribuídas na vertical, em 18 colunas. Os elementos que estão numa mesma coluna, são da mesma família, logo eles representam propriedades físicas e químicas semelhantes, acredito que essa seja uma das primeiras características que iremos trabalhar. Esses elementos fazem parte da mesma família pois tem a mesma quantidade de elétrons na última camada (camada de valência)
A numeração das familias começa em 1A e vai até a 8A, ou pode também ser representada de 1 a 18. Existe também a familia B.
A tabela Periódica é dividida em Metais, Não-Metais e Semi-Metais e suas familias são:
- Família 1A (Grupo 1) Metais Alcalinos
- Família 2A (Grupo 2) Metais Alcalino-Terrosos
- Familia B (Grupo 3 à 12) Metais de Transição
- Família 3A (Grupo 13) Família do Boro
- Família 4A (Grupo 14) Família do Carbono
- Família 5A (Grupo 15) Família do Nitrogênio
- Família 6A (Grupo 16) Calcogênios
- Família 7A (Grupo 17) Halogênios
- Família 8A (Grupo 18) Gases Nobres
PROPRIEDADES PERIÓDICAS, APERIÓDICAS E CONSTANTES
Propriedades periódicas dos elementos são aquelas cujos valores crescem e decrescem sucessivamente a medida que aumenta o numero atômico de modo que, na sequencia dos elementos em ordem crescente do seu numero atômico Representando em gráfico cartesiano a variação da propriedade em função do numero atômico otbem-se uma curva do tipo senoide, com máximos e mínimos.
Propriedades aperiódicas são aquelas que sempre crescem ou sempre decrescem a medida que aumenta o numero atômico, de tal modo que não ha repetição de valores, altos, meios e baixos para a propriedade.
PROPRIEDADES PERIÓDICAS
Energia de Ionização
Energia de ionização é a energia minima necessária para remover um elétron do átomo desse elemento no estado gasoso.
Na determinacao experimental da energia de ionizacao , o eletron que e removido do atomo e o mais distante do nucleo, porque e atraido com menor forcao por ele. Por isso, a energia de ionizacao varia no sentido contrario ao do raio atomico. Quanto menor for o raio atomico,mais proximo do nuleo estara o eletron a ser removido e maior sera a energia necessaria para retira-lo do atomo, e vice-versa.
Raio Atômico
Embora aplicado, o conceito de raio atômico e vago e não tem sentido, uma vez que o átomo não tem um contorno nítido O raio atômico da apenas uma ideia da distancia media do núcleo a região de máxima probabilidade de localização dos elétrons do nível de energia mais extenso.
Comparando-se o raio atômico com a posição dos elementos na Tabela Periódica, verifica-se que:
Num mesmo grupo (família) o raio atômico cresce com o numero atômico crescente, portanto de cima para baixo. Isso e perfeitamente compreensível pois o numero de níveis para baixo, camadas nas quais distribuem elétrons aumenta de cima para baixo.
Num mesmo período o raio atômico decresce com o numero atômico crescente, portanto da esquerda para direita. Aqui talvez já não seja tao simples explicar. Num mesmo período os átomos tem seus elétrons distribuídos no mesmo numero de camadas, mas a medida que aumenta o numero atômico também aumenta o numero de prótons e de elétrons Consequentemente, aumenta a atracão núcleo-eletrosfera e diminui o raio atômico.
Substancias e misturas
Sistema Homogeneo e sistema heterogeneo
Quando precisamos fazer um teste em determinada qyabtudade de substancia, e necessario primeiro isolarmos uma porcao do resto. para dai analisarmos a substancia como um todo. Essa parte e denominada Sistema
CONCEITO: Sistema e uma porcao limitada do universo, considerada como um todo para efeito de estudo.
Podemos como exemplo analisar dois sitesmas classicos
Primeiro = Agua + Alcool
Segundo = Agua + Gasolina
Se coletarmos duas amostras de cada sistema observaremos que:
Quando comacamos a analisar o primeiro sistema ele parece ter todo a mesma cor, mesmo cheiro e parece todo igual. Fazendo experiencias, verifica-se que tem tambem mesma densidade, mesmo ponto de ebulicao (PE) e mesmo ponto de fusao (PF). Conclui-se que as amostras sao, de fato iguais
Em outras palavras as propriedades do sistema (agua + alcool) sao as mesmas em qualquer ponto retirado do total.
Agora nas amostras do segundo sistema (agua + gasolina). Elas tem cores e cheiros diferentes; uma delase inflamavel a outra nao. Realizando experiencias com essas duas amostras, verifica-se que elas tem diferentes densidades, PF e PE diferentes. Conclui-se que sao diferentes.
Dizemos entao que o sistema (agua + alcool) e homogeneio e que o sistema (agua + gasolina) e heterogeneo.
SISTEMA HOMOGENEO e aquel que apreenta as mesmas propriedades em QUALQUER parte de sua extensao que seja examinada
SISTEMA HETEROGENEO e aquele que nao apreenta as mesmas propriedades em qualquer ponto de sua extensao que seja examinada.
Nos sistemas heterogeneos, observamse duas ou mais porcoes, em si homogeneas, limitadas por superficies de separacao. Essas diferentes porcoes homogeneas que constituem os sistemas heterogeneos sao chamados de fases do sistema heterogeneo. No sistema agua + gasolina, ha duas fases : a fase agua e a fase gasolina.
DEFINICAO: Fases sao as diferentes porcoes homogeneas, limitadas por superficies de separacao, que constituem um sistema heterogeneo.
Todos os sistemas heterogeneos sao POLIFASICOS, isto e, sao formados por duas ou mais fases. Podem ser bifasicos (duas fases), trifasicos (tres fases), etc. Por outro lado, todos os sistemas homogeneos sao formados por uma unica fase, iso e, sao sistemas monofasicos ou unifasicos.

















