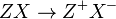13. Ácidos ,bases, sais e óxidos: Conceitos, nomenclatura e classificação; propriedades de suas soluções aquosas; processos de obtenção das substâncias mais usadas.
16:27 17.06 Boa tarde, hoje começaremos a falar sobre ácidos, bases, sais e óxidos, conceitos, características ..
Função Química
Função química é um conjunto de substância com propriedades químicas semelhantes. As principais funções da química são: ácidos, bases, sais e óxidos.
Ácidos
Antes da teoria de Arrhenius, os ácidos eram conceituados através de uma série de propriedades comuns, como:
apresentar sabor azedo;
tornar róseo o papel de tornassol azul;
conduzir corrente elétrica;
quando adicionados ao mármore e a outros carbonatos, produzir eferverscência, com liberação de gás carbônico.
Depois de Arrhenius, pôde-se entender que essas propriedades comuns são consequência da fato de todos os ácidos apresentarem o mesmo íon positivo H+ oAntes de se dissolverem em água, os ácidos são compostos moléculares. A ionização ocorre quando são dissolvidos em água. Assim verifica-se experimentalmente que todos os ácidos conduzem corrente elétrica.
São substância que em solução aquosa sofre ionização, liberando como cátion somente H+

Svante August Arrhenius. Recebeu o Nobel de Química de 1903, "Em reconhecimento dos serviços extraordinários concedidos ao avanço da Química pela sua teoria electrolítica da dissociação".
Base: São substânicas que, em solução aquosa, liberam como íons negativos somente OH-
Antes da teoria de Arrhenius, as bases eram conceituadas por uma série de propriedades comuns, como:
possuir sabor adstringente, isto é, "amarrar a boca";
tornar a pele lisa e escorregadia;
tornar azul o papel róseo de tornassol;
conduzir corrente elétrica.
Depois de Arrhenius, foi possível entender que essas propriedades comuns se devem ao íon negativo OH- (hidroxila ou hidróxido), presente em todas as bases.
Os hidróxidos de metais são compostos iônicos e por isso, quando se dissolvem em água, há dissociação iônica. Na época de Arrhenius, pensava-se que esses hidróxidos eram formados por moléculas e que a água separava-as em íons.

Sal: toda substância que em solução aquosa, sofre dissociação iônica, liberando pelo menos um cátion diferente do H+ e pelo menos um ânion diferente do OH-